Visualisez la vidéo ci-dessous.
Extrait d’une vidéo réalisée par l'ADEGEB et We Up sur un financement de la société RICHARDSON et la participation du centre de formation AFORTECH.
La combustion est une réaction chimique dans laquelle des molécules d’oxygène se combinent avec celles d’un combustible. Cette réaction libère de l’énergie, particulièrement sous forme de chaleur.
Exemple
C + O2 → CO2 + chaleur
Lors de la combustion, la combinaison d'une molécule de carbone (symbole chimique C) et d'une molécule d’oxygène (en réalité de "dioxygène", symbole chimique O2) crée une molécule de dioxyde de carbone (symbole chimique CO2) et libère de la chaleur.
Le CO2 est communément appelé "gaz carbonique".
Question
Le bois.
Le charbon (qui est du bois fossilisé).
Exemple
La combinaison d’une molécule de soufre S et d’une molécule de dioxygène O2 crée une molécule de dioxyde de soufre SO2 et libère de la chaleur.

Exemple
La combinaison de 2 molécules d’hydrogène (en réalité de "dihydrogène") avec une molécule de dioxygène génère 2 molécules d’eau sous forme de vapeur (H2O) et libère de la chaleur.
La plupart des combustibles utilisés pour le chauffage des bâtiments contiennent des molécules d’hydrogène H.
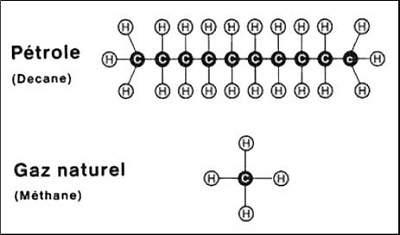
Le gaz naturel (GN) est pour l’essentiel constitué de molécules de méthane de type CH4.
La combinaison d’une molécule de méthane avec 2 molécules de dioxygène génère une molécule de CO2, 2 molécules de vapeur d’eau (H2O) et libère de la chaleur.
CH 4 + 2O2 → CO2+ 2H2O + chaleur
Question
CH 4 + 2O2 → CO2+ 2H2O
Indiquez les symboles chimiques des molécules présentes dans l'équation ci-dessus qui correspondent,
- à l'oxygène,
- au gaz carbonique,
- au gaz naturel,
- à la vapeur d'eau.
- Oxygène = O (dioxygène = O2 )
- Gaz carbonique = CO2
- Gaz naturel = CH4
- Vapeur d'eau = H2O
On distingue les combustibles solides (charbon, bois), liquides (fuel domestique, fioul lourd) et gazeux (gaz naturel, GPL).
Les GPL (butane et propane) sont des Gaz de Pétrole Liquéfiés obtenus à partir du pétrole.
Lorsqu'une chaudière peut être utilisée avec plusieurs combustibles différents, elle est dite polycombustible.
Question
Indiquez ci-dessous le type de chaudière.

De gauche à droite on distingue,
- une chaudière charbon/bois (enfournement manuel du charbon ou du bois),
- une chaudière pouvant être équipé d'un brûleur au gaz ou d'un brûleur au fuel (on peut distinguer le brûleur en partie basse),
- une chaudière polycombustible (on peut distinguer l'enfournement manuel du charbon ou du bois et, en bas, un brûleur fuel de couleur rouge).
Dans les chaudières à combustible solide, le bois ou le charbon
était autrefois enfourné manuellement. Il existe aujourd'hui des chaudières à combustibles solides préparés sous formes de granulés, qui peuvent être automatiquement introduits en fonction des besoins de chauffage.
Les chaudières gaz et fioul sont par contre toutes équipées d'un brûleur en charge
de l'amenée de combustible et éventuellement de l'air nécessaire à la combustion (air comburant).
Les gaz de combustion s'évacuent par le "conduit de fumée" ou par l’intermédiaire d'un "conduit ventouse" dont nous verrons ultérieurement le fonctionnement.

